ทั้งหมด
ประกาศสำนักงานคณะกรรมการอาหารและยา เรื่อง บัญชีรายการยากำพร้า พ.ศ. 2563 ด้วยคณะกรรมการยาได้แต่งตั้งคณะอนุกรรมการกำกับดูแล และแก้ไขปัญหาการขาดแคลนยาเพื่อทำหน้าที่พิจารณา จัดทำและปรับปรุงแก้ไขรายการยากำพร้า รวมทั้งให้ข้อเสนอแนะในการปรับปรุงแก้ไขกฎหมาย ระเบียบ หลักเกณฑ์ต่างๆ เพื่อสนับสนุนการแก้ไขปัญหาการขาดแคลนยากำพร้า ซึ่งคณะอนุกรรมการฯ ในการประชุมครั้งที่ 1/2563 เมื่อวันที่ 18 สิงหาคม พ.ศ. 2563 ได้มีมติให้ปรับปรุงรายการยาในบัญชีรายการยากำพร้าให้มีความเหมาะสมตามสถานการณ์ปัจจุบัน สำนักงานคณะกรรมการอาหารและยาจึงออกประกาศดังต่อไปนี้ 1. ให้ยกเลิกประกาศสำนักงานคณะกรรมการอาหารและยา เรื่อง บัญชีรายการยากำพร้า พ.ศ.2562 เมื่อวันที่ 27 ธันวาคม พ.ศ.2562 และใช้ประกาศฉบับนี้แทน 2. ให้ยากำพร้าตามประกาศฉบับนี้ หมายถึง ยาที่มีความจำเป็นต้องใช้เพื่อวินิจฉัย บรรเทา บำบัด ป้องกัน หรือรักษาโรคที่พบได้น้อย หรือโรคที่เป็นอันตรายร้ายแรง หรือโรคที่ก่อให้เกิดความทุพพลภาพอย่างต่อเนื่อง หรือยาที่มีอัตราการใช้ต่ำโดยไม่มียาอื่นมาใช้ทดแทนได้ และมีปัญหาการขาดแคลน 3. ให้ยาที่มีชื่อยา รูปแบบยา และข้อบ่งใช้ ตามรายการแนบท้ายประกาศฉบับนี้เป็นยากำพร้า ทั้งนี้ ตั้งแต่บัดนี้เป็นต้นไป ประกาศ ณ วันที่ 9 กันยายน 2563 (ดาวน์โหลดไฟล์ได้จากลิงค์ด้านล่าง)
ข่าวประชาสัมพันธ์งานบัญชียาหลักแห่งชาติ เกณฑ์และขั้นตอนการเสนอยา โดยหน่วยงานรัฐตามโครงการพิเศษเพื่อบรรจุเป็นบัญชี จ(1) ตามที่คณะอนุกรรมการพัฒนาบัญชียาหลักแห่งชาติ มีหน้าที่ในการพิจารณารายการยาที่สมควรบรรจุไว้เป็นยาในบัญชี จ(1) ตามบัญชียาหลักแห่งชาติ ซึ่งเป็นยาในโครงการพิเศษของหน่วยงานภาครัฐที่กำหนดให้มีผู้รับผิดชอบโครงการและงบประมาณ ตลอดจนมีการเสนอโครงการเพื่อพิจารณาเป็นลายลักษณ์อักษร เพื่อให้การเสนอโครงการ จ(1) โดยหน่วยงานภาครัฐเป็นไปในทิศทางเดียวกัน คณะอนุกรรมการฯ จึงได้จัดทำเกณฑ์และขั้นตอนการเสนอยา โดยหน่วยงานรัฐตามโครงการพิเศษเพื่อบรรจุเป็นบัญชี จ(1) และแบบฟอร์มการเสนอยาในโครงการ จ(1) ขึ้น เพื่อให้หน่วยงานรัฐที่ต้องการเสนอโครงการ จ(1) ได้ศึกษาทำความเข้าใจ ก่อนยื่นเสนอโครงการ จ(1) ต่อคณะอนุกรรมการฯ โดยให้ใช้เกณฑ์และขั้นตอนการเสนอยาฯ นี้กับโครงการที่มีการเสนอเพื่อพิจารณาตั้งแต่วันที่ 21 สิงหาคม 2563 เป็นต้นไป รายละเอียดเกณฑ์และแบบฟอร์มดาวน์โหลดได้ด้านล่างนี้
ด้วยคณะอนุกรรมการพิจารณากำหนดราคากลางยา ในการประชุมครั้งที่ 1/2563 เมื่อวันที่ 22 มกราคม 2563 ได้พิจารณาผลการประชุมรับฟังความเห็นและชี้แจงภาครัฐเกี่ยวกับราคากลางยาและกฎระเบียบที่เกี่ยวข้องสำหรับการจัดซื้อยาของภาครัฐ ประจำปี 2562 และมอบฝ่ายเลขานุการอนุกรรมการฯ สำนักพัฒนามาตรฐานระบบข้อมูลสุขภาพไทย (สมสท.) และกองบริหารการสาธารณสุข (กบรส.) สืบค้นข้อมูลรหัสยาชื่อสามัญและหน่วยการใช้ (Generic Product Use : GPU) ตามที่ สมสท.กำหนด ลงกำกับในรายการยาแนบท้ายประกาศคณะกรรมการพัฒนาระบบยาแห่งชาติ เรื่อง กำหนดราคากลางยา ลงวันที่ 2 มิถุนายน 2563 เพื่อเพิ่มความชัดเจนและความสะดวกแก่โรงพยาบาลในการจัดซื้อยา ในการนี้ คณะอนุกรรมการพิจาณากำหนดราคากลางยา ได้จัดทำรหัสยาชื่อสามัญและหน่วยการใช้ (Generic Product Use : GPU) ตามที่สำนักพัฒนามาตรฐานระบบข้อมูลสุขภาพไทย (สมสท.) กำหนด ลงกำกับในรายการยาแนบท้ายประกาศคณะกรรมการพัฒนาระบบยาแห่งชาติ เรื่อง กำหนดราคากลางยา ลงวันที่ 2 มิถุนายน 2563 เสร็จสิ้น จึงขอประชาสัมพันธ์ให้โรงพยาบาลทราบมา ณ ที่นี้ จึงเรียนมาเพื่อโปรดทราบและแจ้งผู้เกี่ยวข้องต่อไปด้วย จะเป็นพระคุณ
ด้วยคณะอนุกรรมการพัฒนาบัญชีวัคซีนหลักแห่งชาติ ซึ่งแต่งตั้งภายใต้คณะกรรมการพัฒนาระบบยาแห่งชาติ อยู่ระหว่างดำเนินการพิจารณาคัดเลือกวัคซีนไว้ในบัญชียาหลักแห่งชาติ ตามปรัชญา หลักการ และเกณฑ์การจัดทำบัญชี วัคซีนหลักแห่งชาติ ที่คณะกรรมการฯ กำหนด นั้น คณะอนุกรรมการฯ จึงขอเวียนแจ้งหน่วยงานรัฐและเอกชนที่มีความประสงค์จะเสนอวัคซีนเพื่อขอรับการพิจารณาให้บรรจุในบัญชียาหลักแห่งชาติ โปรดส่งแบบเสนอวัคซีน ได้ที่กลุ่มนโยบายแห่งชาติด้านยา กองยา อาคาร 4 ชั้น 5 สำนักงานคณะกรรมการอาหารและยา ในวันและเวลาราชการ โดยให้ส่งเป็น hard copy จำนวน 1 ชุด และ electronic file (CD/DVD) จำนวน 2 ชุด รายลละเอียดตามเอกสารสิ่งที่ส่งมาด้วย 1-4 กรุณาส่งข้อมูลกลับมาภายในวันที่ 31 สิงหาคม 2563
ด้วยคณะอนุกรรมการพัฒนาบัญชีวัคซีนหลักแห่งชาติ ซึ่งแต่งตั้งภายใต้คณะกรรมการพัฒนาระบบยาแห่งชาติ อยู่ระหว่างดำเนินการพิจารณาคัดเลือกวัคซีนไว้ในบัญชียาหลักแห่งชาติ ตามปรัชญา หลักการ และเกณฑ์การจัดทำบัญชี วัคซีนหลักแห่งชาติ ที่คณะกรรมการฯ กำหนด นั้น คณะอนุกรรมการฯ จึงขอเวียนแจ้งหน่วยงานรัฐและเอกชนที่มีความประสงค์จะเสนอวัคซีนเพื่อขอรับการพิจารณาให้บรรจุในบัญชียาหลักแห่งชาติ โปรดส่งแบบเสนอวัคซีน ได้ที่กลุ่มนโยบายแห่งชาติด้านยา กองยา อาคาร 4 ชั้น 5 สำนักงานคณะกรรมการอาหารและยา ในวันและเวลาราชการ โดยให้ส่งเป็น hard copy จำนวน 1 ชุด และ electronic file (CD/DVD) จำนวน 2 ชุด รายลละเอียดตามเอกสารสิ่งที่ส่งมาด้วย 1-4 กรุณาส่งข้อมูลกลับมาภายในวันที่ 31 สิงหาคม 2563
ตามหนังสือด่วนที่สุด ที่ กค (กวจ) ๐๔๐๕.๒/ว ๒๑๓ ลงวันที่ ๗ พฤษภาคม ๒๕๖๒ คณะกรรมการวินิจฉัยปัญหาการจัดซื้อจัดจ้างและการบริหารพัสดุภาครัฐ กรมบัญชีกลาง ได้กำหนดแนวทางปฏิบัติในกรณีที่ยารายการใดที่คณะกรรมการพัฒนาระบบยาแห่งชาติ โดยคณะอนุกรรมการพิจารณากำหนดราคากลางยาอยู่ระหว่างการพิจารณาทบทวนปรับปรุงราคากลางยา เพื่อกำหนดราคากลางยาใหม่ นั้น เพื่อให้เป็นไปตามแนวทางปฏิบัติดังกล่าว กองยาจึงขอแจ้งประกาศรายการยาที่คณะอนุกรรมการพิจารณากำหนดราคากลางยาอยู่ระหว่างพิจารณาทบทวนปรับปรุงราคากลางยา ตามมติอนุกรรมการฯ ในการประชุมครั้งที่ 8/2563 เมื่อวันที่ 26 สิงหาคม 2563 จำนวน 3 รายการ รายละเอียดตามเอกสารแนบ เพื่อให้หน่วยงานของรัฐ ใช้อ้างอิงในการจัดซื้อยาตามพระราชบัญญัติการจัดซื้อจัดจ้างและ การบริหารพัสดุภาครัฐ พ.ศ. ๒๕๖๐ ต่อไป จึงเรียนมาเพื่อโปรดทราบ
ตามหนังสือที่อ้างถึง คณะกรรมการวินิจฉัยปัญหาการจัดซื้อจัดจ้างและการบริหารพัสดุภาครัฐ กรมบัญชีกลาง ได้กำหนดแนวทางปฏิบัติในกรณีที่ยารายการใดที่คณะกรรมการพัฒนาระบบยาแห่งชาติ โดยคณะอนุกรรมการพิจารณากำหนดราคากลางยาอยู่ระหว่างการพิจารณาทบทวนปรับปรุงราคากลางยา เพื่อกำหนดราคากลางยาใหม่ นั้น เพื่อให้เป็นไปตามแนวทางปฏิบัติดังกล่าว กองยาจึงขอแจ้งประกาศรายการยาที่คณะอนุกรรมการพิจารณากำหนดราคากลางยาอยู่ระหว่างพิจารณาทบทวนปรับปรุงราคากลางยา ตามมติอนุกรรมการฯ ในการประชุมครั้งที่ 7/2563 เมื่อวันที่ 6 สิงหาคม 2563 จำนวน 1 รายการ ได้แก่ Testosterone enanthate sterile solution 250 mg/amp เพื่อให้หน่วยงานของรัฐ ใช้อ้างอิงในการ จัดซื้อยาตามพระราชบัญญัติการจัดซื้อจัดจ้างและการบริหารพัสดุภาครัฐ พ.ศ. ๒๕๖๐ ต่อไป จึงเรียนมาเพื่อโปรดทราบ
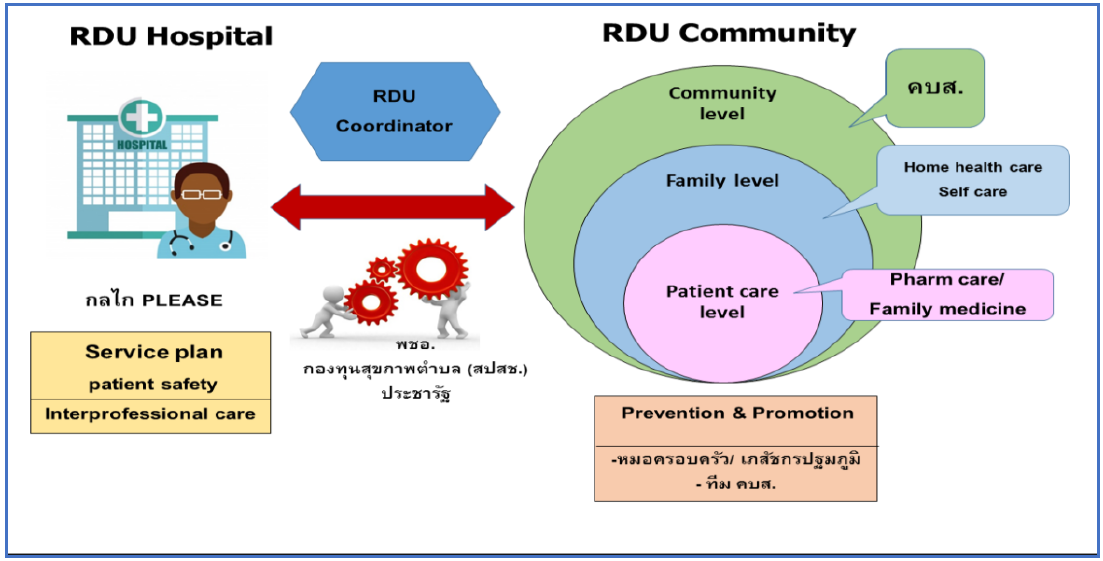
(ร่าง) แนวทางการดำเนินงานพัฒนาระบบการใช้ยาอย่างสมเหตุผลในชุมชน ความปลอดภัยจากการใช้ยาในชุมชน มีปัจจัยที่เกี่ยวข้องหลายปัจจัย ได้แก่ ผู้ใช้ยา ผู้สั่งใช้ยาผู้ผลิต การกระจายยา และการกำกับดูแลตามกฎหมายยา จากการทบทวนงานวิจัยในประเทศไทยที่เกี่ยวข้องพบว่าสาเหตุส่วนหนึ่งเกิดจากผู้ใช้ยาขาดความรู้ที่ถูกต้อง มีความเชื่อที่ผิดๆ และที่สำคัญมีแหล่งจำหน่ายยาที่ไม่เหมาะสมและผิดกฎหมายกระจายอยู่ทั่วไป กระทรวงสาธารณสุข โดยคณะทำงานพัฒนาระบบการใช้ยาอย่างสมเหตุผลและปลอดภัยในชุมชน (RDU Community) ภายใต้การทำงานของคณะทำงานพัฒนาระบบเภสัชกรรม กระทรวงสาธารณสุข ร่วมกับภาคีเครือข่ายที่เกี่ยวข้อง สำนักงานคณะกรรมการอาหารและยา ศูนย์วิชาการเฝ้าระวังและพัฒนาระบบยา (กพย.) สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) อาจารย์จากคณะเภสัชศาสตร์ และสำนักงานสาธารณสุขจังหวัด/โรงพยาบาล ได้ร่วมกันจัดทำแนวทางการดำเนินงานพัฒนาระบบการใช้ยาอย่างสมเหตุผลในชุมชนขึ้น โดยมีวัตถุประสงค์เพื่อให้เจ้าหน้าที่ผู้ปฏิบัติงานและผู้เกี่ยวข้องใช้เป็นแนวทางในการดำเนินงานในชุมชน ที่จะต้องมีความเชื่อมโยงกันระหว่าง 5 กิจกรรมหลัก (5 key activities) อย่างเป็นระบบ
ตามหนังสือด่วนที่สุด ที่ กค (กวจ) 0405.2/ว 213 ลงวันที่ 7 พฤษภาคม 2562 คณะกรรมการวินิจฉัยปัญหาการจัดซื้อจัดจ้างและการบริหารพัสดุภาครัฐ กรมบัญชีกลาง ได้กำหนดแนวทางปฏิบัติในกรณีที่ยารายการใดที่คณะกรรมการพัฒนาระบบยาแห่งชาติ โดยคณะอนุกรรมการพิจารณากำหนดราคากลางยาอยู่ระหว่างการพิจารณาทบทวนปรับปรุงราคากลางยาเพื่อกำหนดราคากลางยาใหม่ นั้น เพื่อให้เป็นไปตามแนวทางปฏิบัติดังกล่าว กองยาจึงขอแจ้งประกาศรายการยาที่คณะอนุกรรมการพิจารณากำหนดราคากลางยาอยู่ระหว่างพิจารณาทบทวนปรับปรุงราคากลางยา ตามมติอนุกรรมการฯ ในการประชุมครั้งที่ 6/2563 เมื่อวันที่ 24 มิถุนายน 2563 จำนวน 20 รายการ เพื่อให้หน่วยงานของรัฐใช้อ้างอิงในการจัดซื้อยาตามพระราชบัญญัติการจัดซื้อจัดจ้างและการบริหารพัสดุภาครัฐ พ.ศ. 2560 ต่อไป
ประกาศคณะกรรมการพัฒนาระบบยาแห่งชาติ เรื่อง กำหนดราคากลางของยา ฉบับนี้ ได้แก้ไขปรับปรุงราคากลางยา จากประกาศฉบับเดิม (ฉบับลงวันที่ 9 ธันวาคม 2562) จำนวน 168 รายการ โดยมีรายการยาที่มีรายงานปัญหาการจัดซื้อ จำนวน 16 รายการ ดังต่อไปนี้ 1. Aminophylline sterile sol 25mg/ml (10 ml) 2. Ampicillin sterile pwdr 500 mg 3. Chlorpromazine hydrochloride tab 25 mg 4. Chlorpromazine hydrochloride tab 50 mg 5. Chlorpromazine hydrochloride tab 100 mg 6. Doxycycline hyclate cap/tab 100 mg 7. Lidocaine spray 10% (50 ml) 8. Loperamide hydrochloride cap/tab 2 mg 9. Medroxyprogesterone acetate sterile susp 50 mg/ ml (3 ml) 10. Nifedipine cap/tab 10 mg 11. Phenylephrine hydrochloride eye drop 10% (5ml) 12. Quetiapine tab 25 mg 13. Sulfadiazine tab 500 mg 14. Thioridazine tab 25 mg 15. Thioridazine tab 50 mg 16. Thioridazine tab 100 mg และปรับปรุงเพิ่มเติมราคากลางยาของยากลุ่มที่มีการผูกขาดจำนวน 152 รายการ ได้แก่ รายการยาในกลุ่มที่ 3 กลุ่มยา Anti-neoplastic drugs ลำดับที่ 120 – 156, รายการยาในกลุ่มที่ 4.1 กลุ่มยา Anticoagulants ชนิดรับประทาน ลำดับที่ 14, รายการยาในกลุ่มที่ 4.2 กลุ่มยา Anticoagulants ชนิดฉีด, รายการยาในกลุ่มที่ 5 กลุ่มยา Drugs for Pulmonary Arterial Hypertension, รายการยาในกลุ่มที่ 9.1 กลุ่มยา statins ลำดับที่ 14, รายการยาในกลุ่มที่ 12.8 กลุ่มยา Cephalosporins ลำดับที่ 33, รายการยาในกลุ่มที่ 15 กลุ่มยา Fibrinolytic drugs, รายการยาในกลุ่มที่ 23 กลุ่มยา Atypical anti-psychotic drugs ลำดับที่ 41, รายการยาในกลุ่มที่ 24 กลุ่มยา Anti-dementia drugs ลำดับที่ 19 – 20, รายการยาในกลุ่มที่ 42 กลุ่มยา Disease-modifying therapy for multiple sclerosis ลำดับที่ 8, รายการยาในกลุ่มที่ 59 กลุ่มยา Muscle relaxants (Neuromuscular blocking drugs), รายการยาในกลุ่มที่ 60 กลุ่มยา Intravenous anaesthetics, รายการยาในกลุ่มที่ 61 กลุ่มยา Inhalational anaesthetics, รายการยาในกลุ่มที่ 62 กลุ่มยา Intravenous nutrition ดังปรากฏตามที่แนบท้ายประกาศฯ ฉบับนี้ สำหรับรายการยาอื่นๆ ยังอยู่ในระหว่างขั้นตอนการพิจารณาปรับปรุงราคากลางยา ตามหลักเกณฑ์และขั้นตอนการกำหนดราคากลางยาที่คณะกรรมการฯ กำหนด